抗体配对是在抗体的基础上,对抗体进一步的开发应用。其中参与配对的抗体能够同时结合相同的抗原。通常情况下,一个抗原分子拥有多个抗原决定簇,将抗原直接注入到动物体内,可引起免疫反应产生抗体,针对不同的抗原决定簇会产生不同的抗体。产生的抗体具有特异性与专一性,即一个抗体分子只会特异性地结合一个抗原决定簇。两个针对不同抗原决定簇的抗体,有可能同时结合到同一个抗原分子上,像这种结合到同一抗原分子上的两个抗体就是配对抗体。
需要注意的是,即使两个抗体针对的是同一抗原分子上不同的抗原决定簇,也并不意味着这两个抗体分子一定可以同时与抗原分子结合。当一个抗体与抗原结合后,有可能会导致其他结合位点(抗原决定簇)构型的改变,从而导致其他的抗体无法正常结合到抗原上。此外,由于位阻效应的存在,也可能使两个结合位点距离较近的抗体无法同时结合在抗原上。因此,想要得到可以同时结合在抗原分子上的配对抗体,在制备出抗体后,还需要对抗体进行筛选。
HRP酶标抗体制备
实验步骤——过碘酸钠氧化法:
- 称取5mgHRP酶,溶于0.5mL蒸馏水中
- 加入新配制的0.5mL(0.1mol/L)过碘酸钠溶液,4℃静置30min
- 加入0.5mL(0.16mol/L)乙二醇溶液,室温避光混匀,静置30min
- 加入含5mg抗体的水溶液1mL,混匀装入透析袋,pH9.5碳酸盐缓冲液透析,放4℃,过夜
- 加入0.2mL新配制的(0.5mg/mL)硼氢化钠溶液,混匀,4℃静置2h
- 边搅拌边滴加等体积饱和硫酸铵溶液,4℃静置1h
- 3000r/min离心30min,弃上清,沉淀物用半饱和硫酸铵洗涤2次
- 沉淀物溶于少量pH7.4(0.15mol/L)磷酸盐缓冲液,透析过夜,去除铵离子后,10000r/min离心30min去除沉淀,上清液即为酶结合物
注意事项:
- 为提高标记效率,应严格掌握整个反应体系中的抗体含量。
- ELISA法测定酶标抗体效价。
- 碘酸钠要新鲜配制。
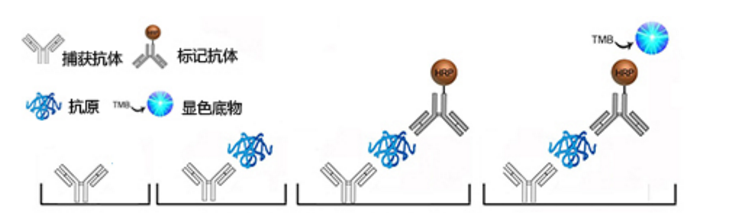
配对抗体的筛选——双抗体夹心ELISA法
取两种效价高的单克隆抗体,一种作为捕获抗体,另一种作为标记抗体(HRP酶标抗体),将捕获抗体包被在固相载体上,先加入抗原,孵育后洗去未结合的抗原,使固相载体上形成抗体抗原复合物,并于液体中的其他物质分开。再加入标记抗体,孵育后洗去未结合的标记抗体,最后加入显色液显色。
- 如果可以显色,说明该捕获抗体与标记抗体为一对配对抗体。可进一步根据呈色的深浅进行定性或定量分析。
- 如果不能显色,说明该捕获抗体与标记抗体不是配对抗体。如果选择的两种单克隆抗体不能进行配对,则需重新选择两种单抗,重新进行试验,直至找出可以配对的抗体。
配对抗体筛选流程:
实验步骤:
- 稀释:用pH9.6(0.01mol/L)碳酸盐缓冲液将单克隆抗体稀释至5μg/mL
- 培养:用捕获抗体包被酶标板后,4℃过夜
- 洗涤:用PBS/T20洗板3次,每次3min
- 封闭:用含3%小牛血清的PBS/T20封闭,37℃孵育1h,洗板
- 加抗原:加入倍比稀释的抗原溶液,37℃孵育45min,洗板
- 加酶标抗体:加入HRP-单克隆抗体,37℃孵育30min,洗板
- 显色:加入TMB显色液,轻轻震荡混匀,37℃避光反应15min
- 终止:加入50μL终止液终止反应
- 测定:酶标仪上读取各孔读取OD450值
注意事项:
- 加样品与酶标板时,应加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
- 注意避光显色。
- 测定应在加终止液后15min以内及时测定。。
实验试剂及仪器
实验试剂:HRP酶、过碘酸钠、乙二醇、碳酸盐缓冲液、硼氢化钠、硫酸铵溶液、磷酸盐缓冲液、碳酸盐缓冲液、PBS/T20、HRP-单克隆抗体、TMB显色液。
实验仪器:离心机、冰箱、酶标仪。
抗体配对的应用
抗体配对常应用于双抗体夹心ELISA实验。能够对目的抗原进行定性定量检测,具有高灵敏度,高特异性及高稳定性的优点,可实现大批量稳定生产。
