什么是流式细胞术?
流式细胞术(Flow Cytometry,FCM)是在流式细胞仪的基础上,对处于快速直线流动状态的单列细胞或生物颗粒进行逐个、多参数、快速定性、定量分析的一种高新技术,具有高通量、多参数、速度快,采集数据量大、操作灵活等优点。最开始检测单细胞内DNA、RNA含量,蛋白质或线粒体等大分子结构和细胞动力学,到如今拓展到细胞表面标志及抗原决定簇的研究、细胞抗原表达、免疫功能测定、细胞分选和鉴定、基因表达蛋白检测、细胞内细胞因子鉴定等多个研究领域,在市场上应用极为广泛。
流式细胞仪
流式细胞仪(flow cytometer,FCM)是以流式细胞术为核心技术,集光学、电子学、流体力学、细胞化学、生物学、免疫学以及激光和计算机等多门学科和技术于一体的先进科学技术设备。是现代科学研究中的先进仪器之一,被誉为实验室的”CT”。流式细胞仪主要由液流系统、光路系统、检测分析系统三部分组成。部分仪器在电子系统中具有分选功能,通过对粒子进行充电和偏转,达到对细胞的分选并分析的目的。
流式细胞术原理
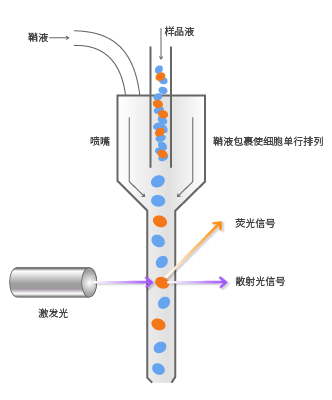
利用流式细胞术快速精确的对单个细胞的理化性质进行定量分析和分选,主要通过几个步骤:制备单细胞悬液,用特异性荧光染料标记的抗体进行染色,经染色后的待测细胞在一定气体压力下被压入流动室,在鞘液的包裹下细胞呈单行排列,依次通过检测区域,在激光束的照射下细胞会产生散射光和激发荧光。这两种信号会同时被光电倍增管( PMT) 接收。接收后可转换为电信号,通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号,进行分析。
流式细胞术实验流程
单细胞悬液的制备
流式细胞术检测的对象一般是细胞,并且是呈独立状态的悬浮于液体中的细胞。如果要检测组织中的细胞,须先将组织制备成单细胞悬液。如果该培养细胞是贴壁细胞,需用胰酶消化处理;如果是胸腺、脾脏和淋巴结等外周免疫器官,直接将脏器用研磨制成单细胞悬液;如果是实体脏器(如肺脏、肝脏和肿瘤组),细胞之间结合较紧密,将脏器剪碎后加入IV型胶原酶和DNA核酸内切酶进行细胞消化后再进行研磨。
荧光标记与上样
细胞悬液制成后,用特异性荧光标记的抗体与细胞上的抗原结合以达到对细胞荧光标记(染色)。在恒定气体的压力下进入流动室,不含细胞或微粒的缓冲液(鞘液[1])在高压下从鞘液管喷出,鞘液管入口方向与待测样品流形成一定角度,鞘液包绕着样品高速流动,组成一个圆柱形的液流束,待测细胞或微粒在鞘液的包被下单行排列,依次通过检测区域。
激光照射及荧光信号收集
流式细胞仪通常以激光作为发光源,经过聚焦的光束垂直照射在样品流上,细胞上的荧光染料被激发,产生散射光和激发荧光。光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。
数据处理分析
荧光信号的强度代表了所测细胞膜表面抗原强度或细胞内物质的浓度,光信号转换为可被计算机识别的电信号。计算机把所测量的各种信号进行处理分析。
细胞分选
细胞分选是指根据所测定的各个参数将指定的细胞从细胞群体中分离出来,流式分选的不是细胞而是包裹了细胞的液滴。在流动室的喷口上方配有一个超高频的压电晶体,产生的振动使喷出的液流形成均匀的液滴,待测细胞就分散在这些液滴之中。将这些液滴充以正负不同的电荷(对标有荧光素的细胞液滴带以负电荷;未标记荧光素的细胞液滴带以正电荷;而不含有细胞的液滴则不被带电荷),当液滴流经偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,不带电荷的液滴落入废液容器,从而实现细胞的分离。
实验对照设置
合理的实验对照是流式实验成功的关键,下面介绍五种实验中必备的实验对照:
- 生物学对照:利用已知的阴性样品和已知的阳性样品设置对照。例如从文献中查阅已知的表达/缺乏感兴趣抗原表达的细胞,或使用RNAi或CRISPR技术将抗原敲除的细胞产生阴性细胞等。
- 空白对照:在流式上机检测之前设置不加任何染料的细胞作为空白对照,得到的荧光信号是细胞本身的非特异性荧光。
- 同型对照:Fc受体位于单核细胞、巨噬细胞、树突状细胞和B细胞上。它们通过其恒定的Fc结构域结合抗体,这种结合会导致假阳性。为了防止这种类型的结合设置了加入FC受体封闭剂,再加入目标抗体的isotype作为同型对照,排除细胞FC受体造成的假阳性结果。
- 单染和补偿对照:当进行多色流式实验时,需要设置单染管进行补偿调节。一般单染管要求有明显的阳性细胞群,对于抗原表达弱的情况,则需要借助补偿微球。
常见问题及分析
1. 细胞无染色或弱染色
- 细胞自发荧光较高:改变抗体的荧光染料形式。避开与自发荧光相同发射光的染料;
- 荧光染料淬灭:荧光抗体和荧光抗体染色后的样本都应该避光保存;
- 激光器性能异常:使用流式细胞仪设定&跟踪微球,以检查激光的校准和功能;
- 数据过度补偿:利用单染色对照和荧光减一对照为每次实验设定补偿;
2. 高背景或存在非特异性染色
- 二抗/试剂存在非特异性结合:滴定二抗,使本底降至最低程度,阻断Fc受体,确保使用已经被高度认可无非特异性的二抗;
- 抗体浓度过高:更改抗体的用量;
- 染色时间太长:根据实验细胞表达,优化抗体浓度和孵育时间;
- 洗涤不充分:增加染色后的洗涤次数;
3. 染色异常情况
- 使用同型对照浓度不对:使用与检测抗体浓度相同的同型对照;
- 使用同型对照来自不同的厂家:使用与实验抗体同一厂家生产的同型对照;
- 固定/破膜液影响细胞固定:调整FSC/SSC电压,使细胞处于可视范围之内。
注释:
[1] 鞘液:鞘液是无荧光本底的平衡电解质溶液,主要成份为氯化钠、氯化钾、乙二胺四乙酸二钠等,作为流式细胞仪对细胞等生物粒子的理化及生物学特性进行分析时的缓冲液使用,目的是包裹细胞使细胞呈直线单行排列流入细胞仪检测区域。
