通常,对于研究人员来说,选择单抗还是多抗作为您的研究是项目启动的第一步。有许多因素需要考虑,包括需要抗体量,抗体的应用和对抗体特异性的要求。单抗和多抗有着各自的优缺点和适用性,在选择时,除了要考虑抗体的应用之外,还要考虑宿主是否适合。
单抗多抗的区别
概念:
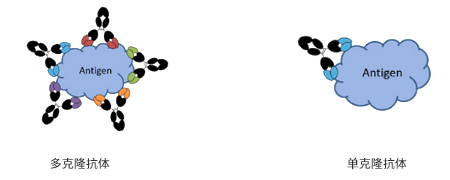
- 单克隆抗体:由单一B淋巴细胞产生的高度均一、仅识别某一特定抗原表位的抗体。
- 多克隆抗体:用一种含有多种抗原决定簇的抗原免疫动物,可刺激机体产生多个B淋巴细胞产生针对多种抗原表位的不同抗体。所获得的免疫血清是含有多种抗体的混合物。
单抗多抗制备流程:
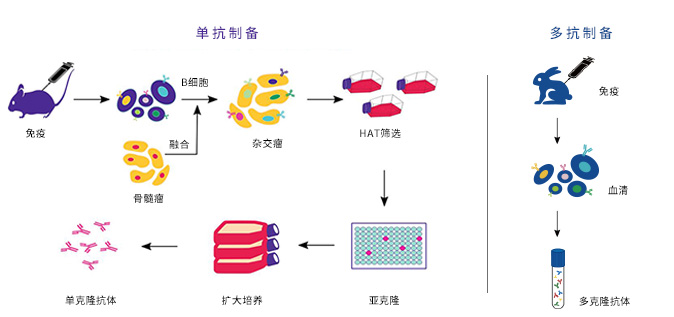
- 单抗制备:抗原免疫动物→获得B淋巴细胞→B细胞与骨髓瘤细胞融合→获得杂交瘤细胞→HAT培养基筛选成功融合的杂交瘤细胞→亚克隆获得单克隆→挑选最好的克隆进行放大培养→获得单克隆抗体
- 多抗制备:抗原免疫动物→收集血清→纯化获得多克隆抗体
单抗VS. 多抗
| 抗体类型 | 优点 | 缺点 | 免疫宿主 |
|---|---|---|---|
| 单克隆抗体 |
|
|
|
| 多克隆抗体 |
|
|
|
单抗成本高,周期长,但特异性好;多抗成本低,周期短,但特异性不及单抗。如果您时间紧迫,费用有限,但又需要特异性高的抗体,单特异性抗体可能是您最好的选择(详细了解单特异性抗体,请与我们联系)。
猜你想读:一抗or二抗该如何选择?
免疫宿主的选择
| 宿主 | 优点 | 缺点 | 适用生产 |
|---|---|---|---|
| 小鼠 |
|
|
|
| 大鼠 |
|
|
|
| 兔 |
|
|
|
| 山羊 |
|
|
|
| 鸡 |
|
|
|
| 骆驼 |
|
|
|
抗体的应用
ELISA的实验原理是基于抗体/抗原的特异性结合,它不仅能够对特定的蛋白进行定量分析,还可以研究分子之间的相互作用或其他特性。将针对靶蛋白的抗体与酶偶联。在加入底物时,这种酶催化底物生成有色产物。通过分光光度计的测定,便可以知道样品中抗原的浓度。常见的ELISA类型有四种:直接ELISA,间接ELISA,夹心ELISA和竞争ELIS。
WB通常被用来确定样品间蛋白的相对表达水平,还可以确定目标蛋白的分子量大小,这有利于我们对蛋白的翻译后修饰过程进行研究。根据分子量大小的不同,通过凝胶电泳分离蛋白质。接着,将蛋白被转移到PVDF/NC膜上,随后用抗体来检测,确定样品中蛋白的含量。
免疫沉淀是分离纯化单一或复合蛋白的最常用的一种方式。抗体被固定在固相基质上(如磁珠),从复杂溶液中捕获抗原。免疫共沉淀,是在捕获抗原的同时,验证溶液中是否存在具有相互作用的物质。
免疫组化是利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原,对其进行定位、定性及定量的研究。相比与WB和ELISA,它的定量分析应用较少,但是在完整组织中对于蛋白表达的分析更有优势。IHC染色是通过抗体识别靶蛋白实现的。抗原抗体复合物能够通过酶促反应或者荧光来实现可视化。这些底物可以直接偶联到一抗或二抗上。
ICC通常使用荧光标记的抗体来研究蛋白的亚细胞分布。与IHC相比,该技术提供了更高的空间分辨率,因为培养的细胞不会有组织样本的复杂环境。
流式细胞术是一种在细胞分子水平上通过单克隆抗体对单细胞或其他生物粒子进行定量分析和分选的检测手段。它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,包括细胞大小和细胞表面以及细胞内标记物的表达量。细胞分选(FACS)是一种更复杂的系统,将细胞从多细胞样品中分离出来。该方法用抗体标记细胞,同时被用的抗体被荧光标记或连接免疫磁珠,利用荧光和免疫磁珠的特性来分离细胞。
