GST pull down(GST融合蛋白沉降技术)是体外检测蛋白相互作用的常用方法,可验证已知蛋白之间的互作,也可用于筛选与已知蛋白互作的未知蛋白。此方法操作方便,简单易行。
GST pull down实验原理
GST pull down的主要原理是利用DNA重组技术将已知蛋白与GST融合,而融合蛋白通过GST与固化在载体上的GTH(谷胱甘肽)亲和结合。简单来说,我们假定a蛋白和b蛋白可能存在互作,将纯化的融合GST的a蛋白和纯化的b蛋白以及能特异性结合GST的Sephrose 4B beads混合在一起孵育一定时间,然后洗去未结合的蛋白,煮沸beads进行SDS-PAGE电泳。通过Western blot检测结果,我们可以看到GST-a蛋白和b蛋白所对应的条带,即表明了a蛋白和b蛋白因发生相互作用而被GST-a pull down(GST对照只显示一个条带)。
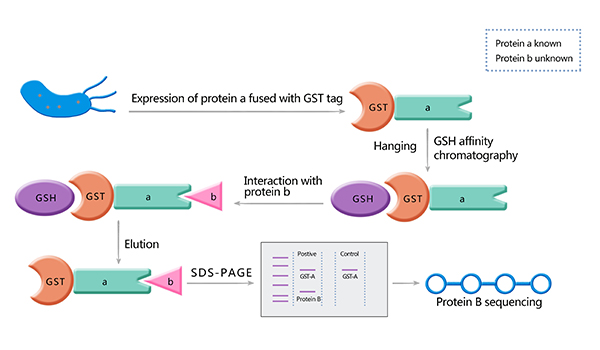
GST pull down实验步骤
GST-a融合蛋白的制备
1.GST-a融合蛋白的表达
(1)将目的蛋白与GST的重组质粒转化到BL21菌株中;
(2)挑取单克隆到含有5ml LB培养基(加入5ul氨苄)的10ml试管里,37℃恒温振荡培养箱中培养过夜;
(3)将培养菌液转移到含有500ml LB(含500ul氨苄)的1L锥形瓶中,37℃,200rpm培养数小时;
(4)测定OD600值,当OD600达到0.6左右时,加入适当浓度的IPTG,在20℃,200rpm条件下培养10-16h(通常需要进行预实验以确定最佳IPTG浓度、诱导温度和时间);
(5)诱导适当时间后,将菌液分次倒入50ml离心管中,4℃ 4000rpm离心10分钟,然后弃去上清,收集管底菌体,如暂时不用,可将菌体保存于-80℃冰箱中;
(6)先加入少量PBS于离心管中,离心5-10min后弃去上清,再按每10ml菌液沉淀1ml PBS的量加入相应的PBS,涡旋振荡,使菌体沉淀充分溶解于PBS溶液中;
(7)把混合菌体置于冰水浴中,用超声仪进行破碎。每次超声破碎20s,间隔30s(破碎时间、破碎次数和间隔时间视具体情况而定),经过适当时间超声后,溶液会显得澄清;
(8)将超声后的溶液4℃ 4000rpm离心10分钟,上清液转移至新的离心管中,-80℃保存备用。
2.GST-a融合蛋白的纯化
(1)在新鲜制备的裂解液上清中加入适量体积50% Glutathione Sepharose 4B,4℃摇床上缓慢摇动30~60min;
(2)4℃,4000rpm离心5min,弃去上清,该Sepharose上结合了GST-a融合蛋白;
(3)加入200ul预冷的PBS溶液,轻晃悬浮珠子,将Sepharose洗涤一次,4℃,4000rpm离心5min,弃去上清,重复此步骤3次;
(4)最后一次用移液枪吸走珠子表面的液体,但注意不要吸走珠子,即可获得结合GST-a的Sepharose。
b蛋白的制备
b蛋白可融合His标签进行原核表达,也可融合Flag/HA/Myc等标签进行真核表达。我司通常融合His标签进行原核表达,详细步骤参见His标签蛋白纯化原理与步骤。
体外蛋白的结合
(1)将结合有GST-a融合蛋白的Sepharose 4B悬浮在适量体积的缓冲液中,加入20ul含有b蛋白的溶液,同时采用结合有GST蛋白的Sepharose作为阴性对照,在摇床上晃动4-8h(4℃);
(2)4℃,4000rpm离心5min,弃去上清液;
(3)沿壁加入200ul预冷的缓冲液对Sepharose进行洗涤,
(4)4℃,4000rpm离心5min,弃上清,该步骤重复3次;
(5)吸干Sepharose上面的液体后,加入20ul 1×蛋白电泳上样缓冲液,沸水浴5min,放入-20℃冰箱备用;
(6)通过SDS-PAGE和Western blot进行检测。
