重组蛋白在大肠杆菌、酵母、哺乳动物中的表达可分为三种形式:胞外分泌表达、胞内可溶性表达和胞内不溶性表达(即产物以包涵体形式存在)。以包涵体形式存在的重组蛋白是无生物活性的,需要进行复性处理,然后再进行分离纯化。包涵体纯化与传统生物大分子的分离纯化方法相似,即以分子的等电点、溶解性、亲疏水性以及与其它分子的亲和性等特征为基础进行纯化。
常用的包涵体纯化方法
1. 金属亲和层析
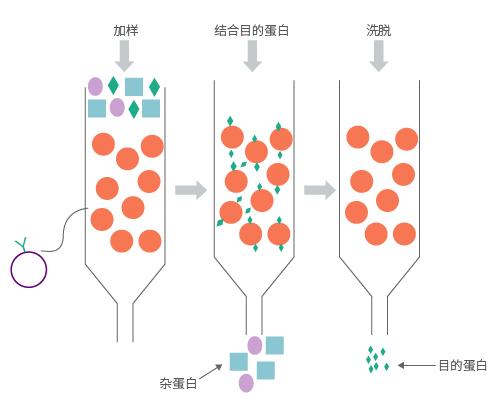
该方法主要利用蛋白质表面暴露的一些氨基酸残基和金属离子之间的相互作用来进行蛋白纯化。我们在载体构建时可以加上一些亲和性标签(如His标签、GST标签、Flag标签等),以便采取亲和纯化的方式纯化蛋白。利用Ni2+和6×His tag之间的亲和性,通过在蛋白的N端或C端加上6~10个组氨酸,在一般或变性条件下借助它与Ni2+螯合柱的紧密结合能力,采用咪唑洗脱,或降低PH使组氨酸充分质子化,使其不再与Ni2+结合,从而分离纯化出带有6×His tag的融合蛋白,纯度通常能达到90%以上。
2. 离子交换层析
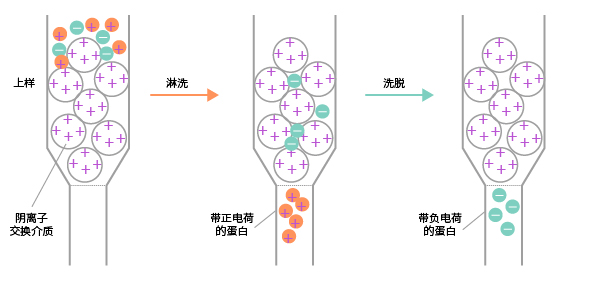
离子交换层析是根据在一定pH条件下,蛋白质所带电荷不同而进行的分离的方法。常用的离子交换剂有羧甲基纤维素(阳离子交换剂,弱酸型)和二乙基氨基乙基纤维素(阴离子交换剂,弱碱型)。阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,需要通过提高洗脱液中的盐浓度等措施将其洗脱下来。根据蛋白质结合能力不同,洗脱的速度会存在差异,通常结合较弱的蛋白质先被洗脱。反之,阳离子交换基质会结合带有正电荷的蛋白质,可以通过提高洗脱液的PH或增加洗脱液中的盐浓度将蛋白洗脱下来。
3.凝胶过滤层析
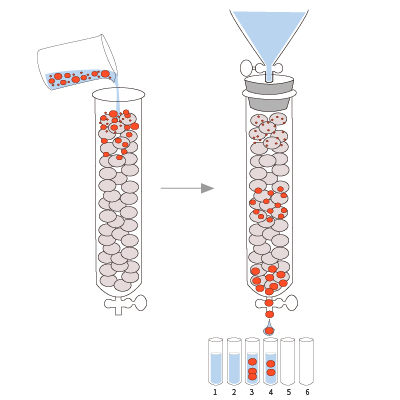
凝胶过滤层析通常又称为分子筛方法,主要是根据蛋白质的大小和形状达到分离和纯化的目的。一般是大分子先流出来,小分子后流出来。此方法的优点在于层析所用的凝胶属于惰性载体,不带电荷并且吸附力弱,可较广的温度范围内进行。先前就有研究报道,用Ni亲和柱层析纯化洗脱的蛋白溶液上样于Superdex-75柱,经过分子筛的纯化,在变性条件下重组蛋白纯度达到95%以上[1]。
4.疏水层析
疏水层析是根据蛋白质表面的疏水性氨基酸残基的数目和空间分布不同,从而决定是否能与疏水填料结合以达到分离目的。该方法基于的是蛋白质的疏水差异,在高浓度盐溶液中,蛋白质会与疏水配基相结合,而其他的杂蛋白则不能,由此可以将蛋白质初步分离。疏水层析的应用与离子交换层析的应用刚好互补,因此,可以用于分离离子交换层析很难或不能分离的物质。
5.反胶团相转移技术
反胶团相转移技术利用表面活性剂分子在有机溶剂中自发形成反相胶团,在一定条件下将溶液中的蛋白质分子增溶进反胶团的极性核中,再创造条件将蛋白质抽提至另一水相,实现蛋白质的相转移,从而达到分离的目的。刘京萍等用CTAB/正辛醇:三氯甲烷(4:1V/V) 反胶团体系对牛血清白蛋白(BSA)进行相转移,找到了实现牛血清白蛋白分离提纯的有效方法[2]。但是,该项技术还存在一些限制,如从有机相到水相反萃取蛋白时产率相对较低。因此,选择适当的体系及介质条件对提高蛋白反萃取率具有重要的意义。
包涵体纯化方法与可溶性蛋白的纯化方法是相似的,关键在于包涵体的溶解与复性,具体步骤见包涵体复性方法。
参考文献:
[1] 张少恩,孙晗笑,张光,等. 大肠杆菌表达的vMIP-Ⅱ包涵体的纯化与复性研究[J].中国生物制品学杂志, 2005, 18(3):247-251.
[2] 刘京萍, 李金. 反胶囊体取牛血清蛋白[J].化学研究与应用, 2004, 16(5):646-649.
