GST标签由211个氨基酸组成,大小约为26KDa。一般利用重组DNA技术插入到目的蛋白的C末端或N末端(大肠杆菌中常用在N端),再利用相应的抗GST标签抗体进行鉴定和检测,广泛应用于重组蛋白表达以及亲和纯化实验中。
GST标签作用机理
① 应用于原核表达;
● 作为一种高度可溶的蛋白,能增加外源蛋白的可溶性
● 在大肠杆菌中大量表达,起到提高表达量的作用
② GST标签蛋白可在温和、非变性条件下洗脱,因此保留了蛋白的抗原性和生物活性;
③ GST在变性条件下会失去对谷胱甘肽树脂的结合能力,因此不能在纯化缓冲液中加入强变性剂(如:盐酸胍或尿素等);
④ GST融合蛋白已经成为分子生物学领域的基本工具,其广泛用于研究蛋白质-DNA及蛋白质-蛋白质间的相互作用,也可作为抗原用于免疫学或疫苗的研究。
GST标签蛋白纯化
通常采用亲和柱层析法,利用谷胱甘肽(GSH)的结构能够和GST的结合位点互补,再利用谷胱甘肽交换洗脱的原理对蛋白进行纯化。
纯化步骤
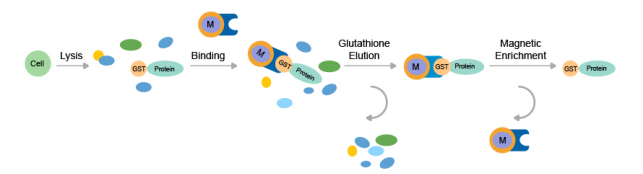
① 在纯化柱中,先将谷胱甘肽偶联到琼脂糖介质上(利用SH基团能与琼脂糖介质上的环氧乙烷结合);
② 由于谷胱甘肽能与GST-tag发生特异性结合,样品加入纯化柱后,带有GST标签的融合蛋白被偶联在介质上的谷胱甘肽配体吸附,而其它蛋白被洗脱;
③ 在非变性条件下加入还原型GSH洗脱液,得到GSH-GST-Protein蛋白复合物。得到的目的蛋白需要去除GST标签,再应用于下游实验。
GST标签的切除
凝血酶:一种应用很广泛的蛋白酶,主要特点是经凝血酶切割后的重组蛋白在切割位点的C端会保留两个氨基酸残基。凝血酶可以识别两种类型的氨基酸序列,分别为X4-X3-P-P[K]-X1΄-X2΄和X2-R[K]-X1΄,凝血酶对前一种序列的识别效果更为理想。
Xa因子:Xa因子是一种较高效的去除融合标签的工具酶,可特异性识别I-E[D]-G-R-X1序列,并将融合标签从其C末端切除。
GST标签纯化优劣势
优势
- 适用范围广,可在不同宿主中表达;
- 增强外源蛋白可溶性;
- 可用不同的蛋白酶进行去除;
- 有助于保持蛋白的抗原性与生物活性,提高外源蛋白的稳定性;
- 特异性好,纯化方便且温和。
劣势
- 分子量较大,可能会影响蛋白质的功能和下游实验;
- 仅能纯化可溶性蛋白,若蛋白不可溶,则很难用变性的方法纯化。
注意事项
① 当融合GST序列的表达载体表达时,部分截短的蛋白产物很容易聚集,可能的原因为:
- GST标签二聚化
- GST标签与目标蛋白之间存在内在易断的连接区域
- 融合蛋白的mRNA与核糖体结合不稳定共同造成
② GST二聚体的每一个亚基含有4个暴露的半胱氨酸残基,会导致很明显的氧化性聚合;
③ 相对于小分子的短肽标签,GST标签融合表达时,需要更多的代谢能量,增加了细胞代谢的负担;
④ GST标签与谷胱甘肽琼脂糖树脂的结合很慢,大规模纯化时需要更多的时间上样;
⑤ GST标签融合蛋白的分子量可能会影响亲和树脂的载量,导致80kDa以上的大分子蛋白质纯化回收率较低。
